中国首个高选择性PI3Kδ抑制剂林普利塞获批上市,系恒瑞医药对外合作成果
2022年11月9日,国家药品监督管理局(NMPA)正式批准林普利塞(商品名:因他瑞?)的新药上市申请,用于治疗既往接受过至少两种系统性治疗的复发或难治(R/R)滤泡性淋巴瘤(FL)成人患者。
林普利塞是恒瑞医药引进的1类新药,由璎黎药业研发,是一种磷脂酰肌醇3-激酶-δ(Phosphoinositide 3-kinase-δ,PI3Kδ)小分子抑制剂,在2022 年公布的林普利塞治疗R/R FL患者的中国II期临床试验最新数据显示,林普利塞治疗R/R FL患者的有效率接近百分之八十,并表现出可控的安全性[1]。
2021年2月,恒瑞医药与璎黎药业达成协议,璎黎药业授予恒瑞医药针对林普利塞在大中华地区的联合开发权益以及排他性独家商业化权益。林普利塞此次获批上市,成为我国首个高选择性PI3Kδ抑制剂,有望为我国R/R FL患者带来新的治疗选择。林普利塞也是恒瑞医药合作产品中第一个获批上市的创新药,为公司开放合作成果落地拉开了序幕,未来公司将与合作伙伴共同努力推动更多创新成果取得进展、惠及更多患者。
淋巴瘤治疗需求迫切,PI3Kδ抑制剂针对性强
淋巴瘤是中国常见的恶性肿瘤之一[2]。世界卫生组织GLOBOCAN 2020 显示,2020年中国新发非霍奇金淋巴瘤(NHL)患者人数达92,834例,其中男性NHL发病率和死亡率居全部恶性肿瘤的第十位[3]。FL是起源于滤泡中心B细胞的一类非霍奇金淋巴瘤,是NHL中最常见的类型之一,占所有NHL病例的10%-20%[3]。随着包括抗CD20单克隆抗体等药物的临床应用,FL患者的生存及预后得到了改善。但是FL仍是一类无法治愈的疾病,经过一线免疫化疗后仍约有20%患者出现早期复发,该类患者预后较差,亟需更加安全有效的治疗药物以诱导患者深度且持久的缓解,改善患者生存及预后情况[3]。近年来新型靶向药物的研发,包括PI3Kδ抑制剂等,推动了淋巴瘤领域精准治疗的发展,也为复发难治淋非霍奇金巴瘤患者带来新的选择。
磷脂酰肌醇3-激酶(PI3K)信号通路参与细胞生长、增殖、分化、运动、存活和细胞内运输等生理活动,对细胞正常功能的维持具有重要生理意义[4]。PI3Kδ是PI3Ks蛋白家族中的一员,主要存在于白细胞中,PI3Kδ信号在多种B细胞淋巴瘤中处于活化状态。PI3Kδ在调节适应性免疫系统细胞(B细胞和部分T细胞)以及先天免疫系统(中性粒细胞、肥大细胞和巨噬细胞)中具有重要作用 [5],因此,被认为是治疗血液系统恶性肿瘤的理想靶点之一。
历时十年研发,林普利塞深入探索淋巴瘤治疗
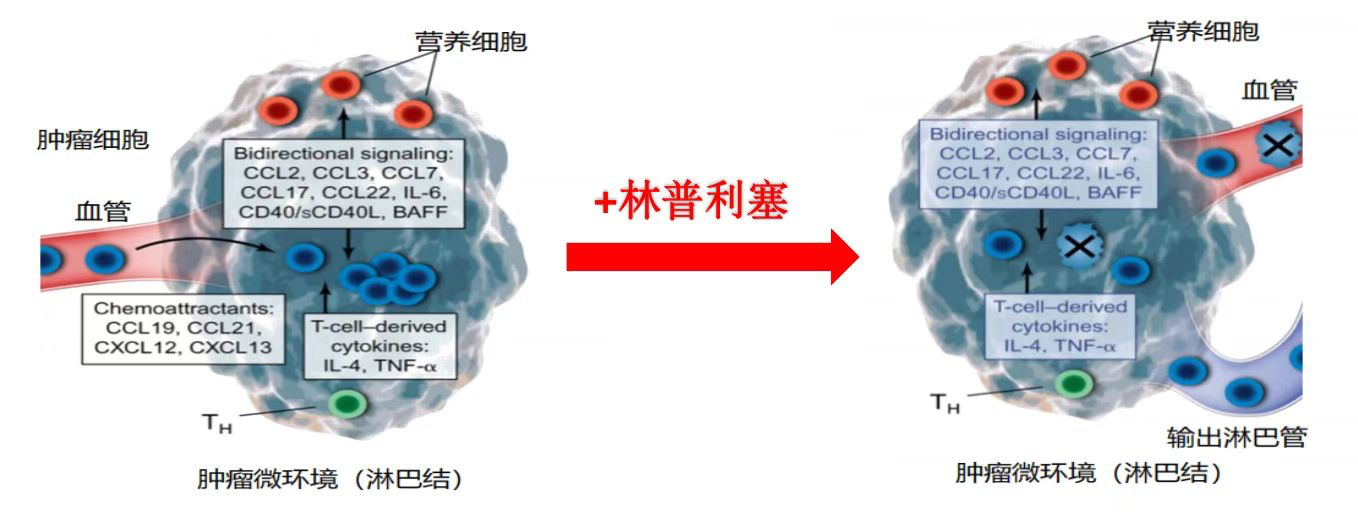
林普利塞作为我国首个高选择性PI3Kδ抑制剂,历经了近十年的研发路。2013年,璎黎药业首次合成化合物YY-20394(林普利塞),其通过双重作用机制,一方面可降低AKT磷酸化水平,进而诱导肿瘤细胞凋亡[6];另一方面,林普利塞进入肿瘤细胞后,对肿瘤免疫微环境具有调节作用,协同肿瘤细胞的凋亡作用共同发挥抗肿瘤效果[7]。
2018年起,林普利塞在淋巴瘤领域开展了一系列临床研究,多项研究结果均显示出其治疗不同亚型的非霍奇金淋巴瘤具有积极效果。
2022 欧洲血液学协会(EHA)年会公布了林普利塞治疗R/R FL患者的中国II期临床试验的最新数据[1],纳入至少接受过2次全身治疗的R/R FL患者,接受林普利塞80mg治疗,口服,每日一次。结果显示,患者总缓解率(ORR)为79.8%,疾病控制率(DCR)达96.6%,12个月总生存(OS)率为91.4%;中位至缓解时间(mTTR)为1.9个月;中位无进展生存期(mPFS)为13.4个月,中位缓解持续时间(mDOR)为12.3个月。安全性方面,林普利塞大多数不良反应可控,患者总体耐受性良好。
林普利塞除在B细胞恶性肿瘤中显示出积极的疗效和可控的安全性外,在T细胞淋巴瘤治疗领域也有不俗表现。林普利塞治疗难治或复发性外周T细胞淋巴瘤(R/R PTCL)的一项Ib研究[8]共纳入43例R/R PTCL患者,接受口服林普利塞80mg治疗,每日一次。在41例可评估疗效的患者中,ORR为61.0%,DCR为90.0%,mPFS为10.3个月。在43例患者的安全性分析中,未出现非预期毒性。
林普利塞的高选择性体现在其对PI3Kδ的选择较其他三种亚型(PI3Kα、PI3Kβ、PI3Kγ)选择倍数均大于30[9],进而有助于降低因抑制其他亚基而易出现的高血糖、高血压及腹泻等不良反应[10],为药物安全性保驾护航。同时,林普利塞的给药方式为口服给药,给药频次为一日一次且不受餐食影响,不同于注射给药或注射与口服给药联合方案,更有助于提升患者依从性,便于临床长期治疗和有效管理。
中国首个高选择性PI3Kδ抑制剂获批,林普利塞致力惠及更多患者
2020年9月,林普利塞已获中国国家药品监督管理局颁发的针对用于R/R FL的突破性疗法认定。此次正式获批上市,标志着林普利塞作为中国首个高选择性PI3Kδ抑制剂全面投入应用,有望进一步完善目前R/R FL、R/R PTCL等非霍奇金淋巴瘤的治疗方案,为更多中国淋巴瘤患者带来新的治疗选择。
据悉,基于多项临床研究验证及独特的药物作用机制,林普利塞目前已获美国食品药品监督管理局(FDA)颁发的针对FL、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、T细胞淋巴瘤三项适应症的孤儿药资格认定。
恒瑞医药副总经理、全球研发总裁张连山博士表示:林普利塞的上市不仅可以进一步丰富公司血液肿瘤产品管线,也可与公司现有产品进行联用探索,服务于更多患者。作为创新型国际化制药企业,恒瑞医药始终坚持以患者为中心进行研发创新,同时也积极开展与国内外优秀同行的合作,在优势互补中促进创新来源多元化,携手推进医药产业健康可持续发展。
璎黎药业研发总裁兼上海璎黎药业总经理许祖盛博士表示:林普利塞是公司自主研发并成功上市的第一个创新药品,对璎黎药业来说是重大的里程碑事件。感谢参与林普利塞临床研究的患者、科学家、临床医生及合作者们的付出,感谢监管部门对林普利塞的认可。我们很欣慰林普利塞迎来了第一个适应症,为复发或难治性滤泡淋巴瘤患者提供了全新、突破性的治疗选择。璎黎药业期待与恒瑞医药的深度融合,全面加速因他瑞?的商业化进程,为淋巴癌患者带来治疗和缓解的新希望。同时,璎黎药业将继续致力于最大化发挥林普利塞的价值,更广泛地评估其在其他适应症上的疗效,并继续推进技术创新与管线开发,早日惠及更多患者。
参考文献:
[1] Lugui Qiu et al. 2022EHA.Abstract 1119
[2]中国抗癌协会淋巴瘤专业委员会,中国医师协会肿瘤医师分会,中国医疗保健国际交流促进会肿瘤内科分会.中国淋巴瘤治疗指南(2021年版)[J].中华肿瘤杂志,2021,43(07):707-735.
[3] 《中国淋巴瘤诊疗指南(2022年版)》
[4] Ersahin, T, et al. (2015). The PI3K/AKT/mTOR interactive pathway. Molecular bioSystems, 11(7), 1946–1954.
[5] Fruman, D. A, et al. (2011). PI3Kδ inhibitors in cancer: rationale and serendipity merge in the clinic. Cancer discovery, 1(7), 562–572.
[6]Kong, D., & Yamori, T. (2008). Phosphatidylinositol 3-kinase inhibitors: promising drug candidates for cancer therapy. Cancer science, 99(9), 1734–1740.
[7]Fruman DA, Rommel C. PI3Kδ inhibitors in cancer: rationale and serendipity merge in the clinic. Cancer Discov. 2011;1(7):562-572.
[8] Jie Jin, et al. 2021 ASH. Abstract 1386.
[9]Vanhaesebroeck, B., Perry, M., Brown, J. R., André, F., & Okkenhaug, K. (2021). PI3K inhibitors are finally coming of age. Nature reviews. Drug discovery, 20(10), 741–769.
[10] Mishra, R., Patel, H., Alanazi, S., Kilroy, M. K., & Garrett, J. T. (2021). PI3K Inhibitors in Cancer: Clinical Implications and Adverse Effects. International journal of molecular sciences, 22(7), 3464.
声明:本网转发此文章,旨在为读者提供更多信息资讯,所涉内容不构成投资、消费建议。文章事实如有疑问,请与有关方核实,文章观点非本网观点,仅供读者参考。
热门推荐
最新动态
文章排行


