国产CART疗法再添新军,开启免疫细胞治疗新篇章
7月30日,国家药品监督管理局正式批准上海恒润达生生物科技股份有限公司(以下简称“恒润达生”)申报的1类创新型生物制品——雷尼基奥仑赛注射液(商品名:恒凯莱?,英文商品名:HICARA?)的新药上市申请。
作为我国首款完全自主研发、针对复发或难治性大B细胞淋巴瘤(r/r LBCL)的CD19 CAR - T产品,雷尼基奥仑赛注射液的获批意义非凡。它不仅填补了国产CAR - T在该领域的空白,更标志着中国免疫细胞治疗技术迈入自主可控的全新阶段,为众多亟待解决的临床难题提供了切实可行的解决方案。
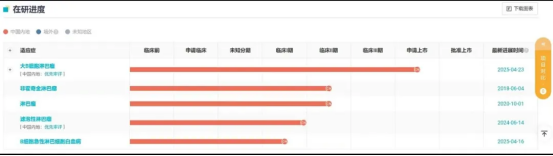
雷尼基奥仑赛是一款CD19靶向CAR - T疗法。Insight数据库显示,这款药物的研发之路始于2016年,在历经多年的潜心钻研与临床试验后,完成II期临床试验的它,于2023年12月向国家药品监督管理局(NMPA)递交了新药上市申请(NDA),并最终顺利获批。此外,据其招股书透露,该药针对复发/难治性CD19阳性B细胞急性淋巴细胞白血病(B - ALL)的适应症,拟于2025年度进入II期临床研发阶段,未来发展前景令人期待。
这一成果的背后,是严谨且科学的临床试验支撑。根据一项在中国开展的开放标签、单臂、多中心(17个中心)的II期临床试验初步结果。该研究精心纳入了81例至少接受过两线治疗(治疗方案必须涵盖蒽环类和CD20靶向药物)或自体造血干细胞移植后的复发/难治性非霍奇金淋巴瘤(R/R NHL)患者。
截至2023年5月16日,这81例患者均接受了剂量为2.0×10? CAR - T细胞/kg的HR001输注。从患者基线情况来看,ECOG评分在0 - 1分,其中男性患者占比51.9%,中位年龄为53.4岁(年龄范围:23 - 74岁),CD19阴性患者占3.7%,弥漫大B细胞淋巴瘤(DLBCL)患者占比高达91.4%。
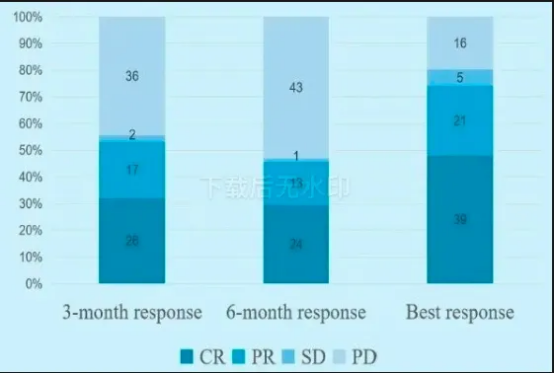
在疗效方面,中位随访时间达160天时,患者3个月、6个月的客观缓解率(ORR)以及最佳ORR分别为53.1%、45.7%和74.1%;3个月、6个月的完全缓解率(CRR)以及最佳CRR分别为32.1%、29.6%和49.4%。中位缓解持续时间(DOR)和无进展生存期(PFS)分别为339天和176天,总生存期(OS)目前尚未达到。研究数据还表明,CAR - T细胞峰值扩增的中位时间为输注后240小时,中位峰值扩增(Cmax)为17413.9 copies/μg DNA (124.9 - 136382.2)。
安全性也是评估一款药物的重要指标。在此次临床试验中,95.1%的患者出现了细胞因子释放综合征(CRS),不过其中仅有3.7%的患者发生了≥3级CRS。8.6%的患者出现了免疫效应细胞相关神经毒性综合征(ICANS),且无≥3级ICANS病例。治疗相关死亡率为1.2%。这些数据充分显示了雷尼基奥仑赛注射液在安全性方面的良好表现。
复旦大学附属中山医院刘澎教授作为本项目的组长单位代表,满怀感慨地表示:“中山医院血液科有幸作为本项目的组长单位,全程参与并亲眼见证了首款治疗复发难治性大B细胞淋巴瘤的国产CD19 CAR - T产品从研发到上市这一具有里程碑意义的突破历程。该药品在此类淋巴瘤患者中展现出了持久的缓解效果,而且整体安全性表现十分优异。它的成功问世,不仅为临床医生对抗这一难治性疾病提供了强有力的武器,更给无数患者及其家庭带来了新的希望与生机。”
声明:本网转发此文章,旨在为读者提供更多信息资讯,所涉内容不构成投资、消费建议。文章事实如有疑问,请与有关方核实,文章观点非本网观点,仅供读者参考。
热门推荐
最新动态
文章排行


